法国Elveflow 微流控系统双体积液滴对数字液滴PCR 定量检测能力提升的研究
2025-12-02 10:46:25 来源:赫尔纳
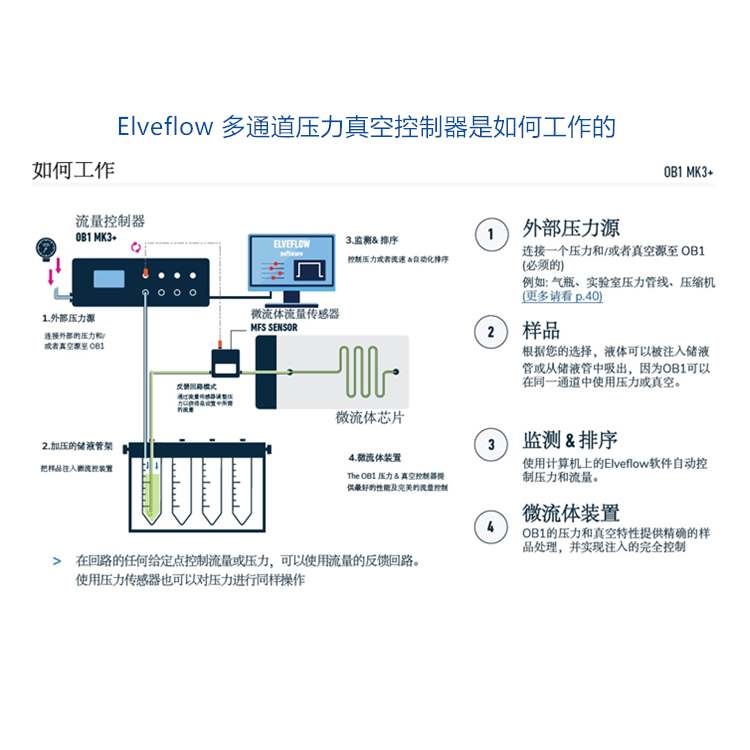 Elveflow 微流控系统双体积液滴对数字液滴PCR 定量检测能力提升的研究
随着分子生物学技术的不断发展以及微机电系统与微纳制造技术的进步,核酸检测技术已成为单细胞分析、遗传病检测、基因序列分析和食品安全等领域的重要工具。以食品安全检测为例,凝胶电泳聚合酶链式反应(PCR)、实时荧光定量PCR、核酸探针、环介导等温扩增、液滴数字PCR(Droplet digital PCR, ddPCR)和数字芯片PCR(Chamber digital PCR, cdPCR)等均为典型的核酸检测技术。与实时荧光定量PCR 相比,数字PCR 技术不依赖于循环阈值和标准曲线,在核酸绝对定量方面具有显著优势。其中,ddPCR 技术通过油包水液滴将样本分割为成千上万份的数字样本,大地提高了PCR 定量检测的灵活性与定量分析性能,其定量分析原理服从泊松分布,应尽量满足“单液滴中包裹不超过1个核酸片段”的前提条件。
数字PCR 技术的3 个核心指标分别是定量上限(Upper limit of quantification, ULQ)、定量下限(Lowerdetection limit, LDL)和动态范围(Dynamic range, DR)。在待测样本总体积一定的前提下, ULQ 与LDL取决于单个液滴的体积。单个液滴体积越小,说明液滴数量越多,可检测的核酸片段丰度的定量上限越高;反之,定量下限越低。目前, ddPCR 多采用体积一致的液滴单元作为反应腔室,面临潜在检测适配性差的问题:对于高浓度核酸样本,若液滴体积偏大,易导致液滴中包裹核酸片段的数量超过1个;对于低浓度核酸样本,若液滴体积偏小,导致空液滴概率显著提高,影响检测效率。对于未知浓度的样本,单一体积的数字液滴PCR 检测无法兼顾ULQ 与LDL,进而影响定量检测结果的精度,在实际操作中通常需要多次尝试以确定液滴体积和核酸丰度的*佳适配条件,难以满足珍贵样本检测场景中的“零试错”需求。
为了降低试错成本,本研究制备了一步法双体积ddPCR 微流控芯片,单步操作可生成一大一小两种尺寸的微液滴,分别适配低丰度和高丰度的核酸样本,适用于对未知浓度的珍贵核酸样本进行绝对定量检测。此微流控芯片包括十字流道区、阶梯区、仓储区和观察区等基本功能单元,其中,十字流道区用于产生柱状母液滴,阶梯区用于母液滴二次乳化生成一大一小两个子液滴[28-29],仓储区用于临时储存液滴和后续的核酸扩增热循环,观察区用于显微图像采集。母液滴和子液滴的尺寸均可以通过调控油水两相流体的进样比例实现按需调整。本研究为未知丰度珍贵样本核酸检测提供了新的解决方案。
1 实验部分
1.1 仪器与试剂
Elveflow正压气源装置,包含OB1 MK4压力控制器(法国Elveflow公司)和MFS3压力传感器(法国Elveflow公司);30L-S1600W 空气压缩机(台州市奥突斯工贸有限公司);SDC200S 接触角测量仪(东莞西瓦卡精密量仪有限公司);VR-R3 等离子键合机(广州善准科技有限公司);TG16G 高速离心机(江苏东华分析仪器有限公司);F-010SD 超声波清洗机(深圳福洋科技有限公司);Nikon DS-Qi2 倒置荧光显微镜(日本Nikon 公司);CKX3-OLYMPUS 显微镜(奥林巴斯中国公司);QX200 AutoDG 数字PCR 扩增仪(美国伯乐生命医学产品有限公司)。
1.2 实验方法
1.2.1 微流控芯片的制备
基于两相流剪切力与水相表面张力相结合的原理,采用液滴制备芯片生成不同体积液滴。将二甲基二氯硅烷试剂滴在真空釜中,并将硅片置于其中,挥发15 min 后即完成易脱模处理,期间注意空气流通。将PDMS 与固化剂按质量比10∶1 混合,进行真空负压抽气泡30 min 后浇筑于硅片,并加热40 min。对PDMS 进行切片、打孔以及等离子键合后,加热,取100 μL Rain-X 疏水试剂,打入PDMS 的流道内部,静置5 min 使壁面疏水化。采用异丙醇冲洗微通道3 min,并进行加热干燥。
1.2.2 核酸样本的制备
取25 mg 鸭肉组织样本,剪碎后置于1 mL 离心管中。移取100 μL MightyPrep 核酸提取液至离心管中,振荡,确保核酸提取液与组织碎块充分混合。在95 ℃加热10 min,使鸭肉组织充分裂解并释放DNA。15000 r/min 离心2 min,吸取上清液,得到PCR 反应所需的DNA 模板。本研究主要的目的是提升ddPCR 微流控芯片的定量检测范围,因此设计了3 种浓度的核酸样本:样本一为DNA 丰度较高的样本,用于分析小体积液滴对于大体积液滴的定量上限的优势;样本二为DNA 丰度较低的样本,用于分析大体积液滴对于小体积液滴的定量下限的优势;样本三为浓度介于二者之间的DNA 样本,用于分析面向中等丰度样本时的定量检测能力。
1.2.3 液滴生成
采用Elveflow OB1 MK4压力控制器驱动油、水两相流体进样。油相为正十四烷与2%(质量分数)鲸蜡基聚乙二醇(EM90)活性剂的混合物。将油相充满整个芯片流道后,再将油水两相样本流体按照一定的比例(根据液滴尺寸需求,气压在2~20 kPa 范围内调节)加压注入到微流控芯片中,生成用于ddPCR 的液滴。
1.2.4 荧光定量PCR 扩增实验
采用鸭源性成分恒温扩增检测试剂盒,反应体系包括37.5 μL 的E 缓冲溶液、2.5 μL 的B 缓冲溶液(Mg2+等)以及0~10 μL 的核酸模板(浓度为100000 copies/μL),不足10 μL 以无菌水补齐。扩增反应参数为扩增温度39~42 ℃,孵化时间4 min,检测通道为FAM,扩增时间15 min。阴性对照组以10 μL 无菌水代替核酸模板。
1.2.5 微流控芯片检测
将包含有扩增后鸭源核酸样本的液滴注入观察芯片,采用荧光显微镜采集荧光图像。采用Image J软件处理采集的荧光图片数据,调整阈值区分液滴的阴阳性,并依据灰度区域的面积区分大小液滴,依据泊松分布原理折算统计计算两个体积液滴分别对应的核酸丰度。
2 结果与讨论
2.1 双体积芯片的制作与液滴的制备
双体积液滴微流控芯片的结构如图1 所示,整体结构为“三明治”结构,自下而上由载玻片基底、PDMS 流道和盖玻片叠加而成。由于芯片的阶梯孔为通孔,为方便后续液滴在下游流道顺利导出,需要在通孔顶部通过键合载玻片将其密封(等离子键合机, 65 W, 30 s)。芯片的油相与水相流道的宽度均为100 μm,高度均为40 μm,在十字交叉区宽度收缩为宽度60 μm,阶梯孔直径为5 mm。
双体积液滴微流控芯片采用标准的软光刻工艺加工,其工作原理如下:通过调节油/水两相流体的进样压力,在十字流道生成不同尺寸的液柱状母液滴,其体积可通过显微图像中液柱的长度和微流道的高度计算;当液柱状母液滴接近阶梯区,下游阶梯结构内流场压力骤降,在压力差与表面张力的综合影响下,母液滴会自发乳化成滴。受到喷嘴处表面张力的约束,液滴的曲率无法无限制增大,因此其尺寸主要取决于喷嘴的几何尺寸。若阶梯结构的上游流体为连续的水相,该过程称之为阶梯乳化。在本研究中,阶梯结构上游的水相体积并非无限供给,因此下游子液滴的体积不再遵循阶梯乳化的物理规律。根据质量守恒原理,阶梯结构下游二次乳化生成的子液滴体积和数量取决于上游母液滴的体积。若液柱母液滴的体积恰好是乳化液滴体积的整数倍(实际上,此处并非需要严格遵守理想整数倍,仅需满足在统计误差允许的范围内近似为整数倍即可),则可在下游获得尺寸均一、单峰正态分布的液滴群;若液柱母液滴的体积不是乳化液滴体积的整数倍,则在阶梯处断裂生成的*后一个子液滴与前序子液滴的体积不再相等,而是取决于液柱状母液滴内水相流体的残余量。此过程仅需要一步操作即可得到双体积的液滴,在下游获得两种尺寸、双峰正态分布的液滴群。通过调节油/水两相流体的进样比例控制液柱状母液滴的体积,即可精准调控下游子液滴的数量和体积。
为验证上述原理,首先以无菌水溶液为分散相研究双体积液滴的两种尺寸关系。将芯片与油相和水相连接后,设置油相压力为4.0 kPa、水相压力为3.8 kPa,得到显微图像序列(图2)。由图2A 可见,在阶梯结构的下游可以观察到两种尺寸的子液滴。图2B~2D 展示了液柱状母液滴临近阶梯时的界面演化过程。母液滴头部首先膨胀,形成舌状前驱体;而后舌状前驱体发生颈缩形成球状前驱体,并从母液滴脱离,形成一个子液滴。此后,上游母液滴中残余的水相体积不足以维持前序子液滴的体积,便在下游处生成了较小体积的*末一个子液滴。
通过改变油相与水相驱动压力的比例,进而调控液柱状母液滴的体积,进一步印证双体积液滴的工作原理。如图3 所示,保持油相压力为4.0 kPa,调节水相压力(3.8~4.0 kPa),液柱状母液滴的长度逐渐增加。由图3 可以明显看到,随着液柱状母液滴长度增加,下游二次乳化的较大子液滴的尺寸几乎不变(仅取决于喷嘴尺寸);由于液柱母液滴内残余水相体积的增加,下游乳化生成的较小液滴的尺寸也逐渐增加,符合预期。采用本方法可以灵活调整下游子液滴的体积和数量。
在油相压力4.0 kPa、水相压力3.8 kPa 的条件下液滴的显微图像和统计直方图如图4 所示,下游子液滴的直径均服从双峰正态分布((40.95±1.61) μm 和(51.48±1.29) μm),两种体积液滴直径的变异系数分别为3.92%和2.51%,满足核酸定量实验需求。图4A 中有极少数的巨型液滴为液滴融合导致,可能是外部振动和微液滴撞融等偶然因素诱导产生的。
2.2 双体积数字PCR 检测DNA
为了探究两种体积液滴所具备的不同的绝对定量能力,设计了3 种不同丰度的鸭源DNA 作为分散相开展核酸检测ddPCR 实验。3 种待测样本的核酸丰度分别为500、5000 和20000 copies/μL,并设置不含核酸的无酶去离子水作为空白对照组。通过双体积微流控芯片制备双体积液滴,将所生成的液滴导出,使用PCR 扩增仪进行扩增后,将液滴导入平铺层观察区,选择FAM 荧光通道观察和分析扩增结果。图5 展示了不同丰度鸭源DNA 模板扩增的荧光结果的灰度图。
从上述结果可见,随着DNA 丰度增加,若以小体积液滴作为定量计算的基准, DNA 靶标的折算偏差从7.722%逐渐减小到0.281%;若以大体积液滴作为定量计算的基准, DNA 靶标的折算偏差从0.444%逐渐增加到17.822%。以偏差不超过5%的可靠性作为阈值,在检测低浓度DNA 靶标时,小体积液滴的绝对定量能力并不理想。同理,随DNA 浓度增加,大体积液滴的定量偏差逐渐增大,在高浓度时其偏差为17.882%,若是继续增加DNA 浓度,大体积液滴将无法实现可靠的绝对定量检测。因此,在面对未知浓度的DNA 靶标时,非常有必要采用不同体积的液滴以满足检测可靠性的要求。
3 结论
为降低对未知丰度核酸样本定量检测的试错成本,本研究设计了一款可生成双体积液滴的微流控芯片,两种体积液滴的数量与体积可通过改变油水两相流体的进样条件灵活调控。上游的十字流道处生成液柱状母液滴,在下游阶梯处二次乳化成两种尺寸的子液滴群,双体积液滴群具有优越的分散性,满足ddPCR 实验需求。以鸭源性DNA 的ddPCR 核酸检测为例考察方法的性能,结果表明,不同体积的液滴包裹同一核酸样本时,折算得到的核酸丰度具有不同的定量精度。后续工作将研究双体积液滴生成和调控机理,尝试采用注塑工艺加工双体积液滴微流控芯片,以满足更多应用场景的需求。
Elveflow 微流控系统双体积液滴对数字液滴PCR 定量检测能力提升的研究
随着分子生物学技术的不断发展以及微机电系统与微纳制造技术的进步,核酸检测技术已成为单细胞分析、遗传病检测、基因序列分析和食品安全等领域的重要工具。以食品安全检测为例,凝胶电泳聚合酶链式反应(PCR)、实时荧光定量PCR、核酸探针、环介导等温扩增、液滴数字PCR(Droplet digital PCR, ddPCR)和数字芯片PCR(Chamber digital PCR, cdPCR)等均为典型的核酸检测技术。与实时荧光定量PCR 相比,数字PCR 技术不依赖于循环阈值和标准曲线,在核酸绝对定量方面具有显著优势。其中,ddPCR 技术通过油包水液滴将样本分割为成千上万份的数字样本,大地提高了PCR 定量检测的灵活性与定量分析性能,其定量分析原理服从泊松分布,应尽量满足“单液滴中包裹不超过1个核酸片段”的前提条件。
数字PCR 技术的3 个核心指标分别是定量上限(Upper limit of quantification, ULQ)、定量下限(Lowerdetection limit, LDL)和动态范围(Dynamic range, DR)。在待测样本总体积一定的前提下, ULQ 与LDL取决于单个液滴的体积。单个液滴体积越小,说明液滴数量越多,可检测的核酸片段丰度的定量上限越高;反之,定量下限越低。目前, ddPCR 多采用体积一致的液滴单元作为反应腔室,面临潜在检测适配性差的问题:对于高浓度核酸样本,若液滴体积偏大,易导致液滴中包裹核酸片段的数量超过1个;对于低浓度核酸样本,若液滴体积偏小,导致空液滴概率显著提高,影响检测效率。对于未知浓度的样本,单一体积的数字液滴PCR 检测无法兼顾ULQ 与LDL,进而影响定量检测结果的精度,在实际操作中通常需要多次尝试以确定液滴体积和核酸丰度的*佳适配条件,难以满足珍贵样本检测场景中的“零试错”需求。
为了降低试错成本,本研究制备了一步法双体积ddPCR 微流控芯片,单步操作可生成一大一小两种尺寸的微液滴,分别适配低丰度和高丰度的核酸样本,适用于对未知浓度的珍贵核酸样本进行绝对定量检测。此微流控芯片包括十字流道区、阶梯区、仓储区和观察区等基本功能单元,其中,十字流道区用于产生柱状母液滴,阶梯区用于母液滴二次乳化生成一大一小两个子液滴[28-29],仓储区用于临时储存液滴和后续的核酸扩增热循环,观察区用于显微图像采集。母液滴和子液滴的尺寸均可以通过调控油水两相流体的进样比例实现按需调整。本研究为未知丰度珍贵样本核酸检测提供了新的解决方案。
1 实验部分
1.1 仪器与试剂
Elveflow正压气源装置,包含OB1 MK4压力控制器(法国Elveflow公司)和MFS3压力传感器(法国Elveflow公司);30L-S1600W 空气压缩机(台州市奥突斯工贸有限公司);SDC200S 接触角测量仪(东莞西瓦卡精密量仪有限公司);VR-R3 等离子键合机(广州善准科技有限公司);TG16G 高速离心机(江苏东华分析仪器有限公司);F-010SD 超声波清洗机(深圳福洋科技有限公司);Nikon DS-Qi2 倒置荧光显微镜(日本Nikon 公司);CKX3-OLYMPUS 显微镜(奥林巴斯中国公司);QX200 AutoDG 数字PCR 扩增仪(美国伯乐生命医学产品有限公司)。
1.2 实验方法
1.2.1 微流控芯片的制备
基于两相流剪切力与水相表面张力相结合的原理,采用液滴制备芯片生成不同体积液滴。将二甲基二氯硅烷试剂滴在真空釜中,并将硅片置于其中,挥发15 min 后即完成易脱模处理,期间注意空气流通。将PDMS 与固化剂按质量比10∶1 混合,进行真空负压抽气泡30 min 后浇筑于硅片,并加热40 min。对PDMS 进行切片、打孔以及等离子键合后,加热,取100 μL Rain-X 疏水试剂,打入PDMS 的流道内部,静置5 min 使壁面疏水化。采用异丙醇冲洗微通道3 min,并进行加热干燥。
1.2.2 核酸样本的制备
取25 mg 鸭肉组织样本,剪碎后置于1 mL 离心管中。移取100 μL MightyPrep 核酸提取液至离心管中,振荡,确保核酸提取液与组织碎块充分混合。在95 ℃加热10 min,使鸭肉组织充分裂解并释放DNA。15000 r/min 离心2 min,吸取上清液,得到PCR 反应所需的DNA 模板。本研究主要的目的是提升ddPCR 微流控芯片的定量检测范围,因此设计了3 种浓度的核酸样本:样本一为DNA 丰度较高的样本,用于分析小体积液滴对于大体积液滴的定量上限的优势;样本二为DNA 丰度较低的样本,用于分析大体积液滴对于小体积液滴的定量下限的优势;样本三为浓度介于二者之间的DNA 样本,用于分析面向中等丰度样本时的定量检测能力。
1.2.3 液滴生成
采用Elveflow OB1 MK4压力控制器驱动油、水两相流体进样。油相为正十四烷与2%(质量分数)鲸蜡基聚乙二醇(EM90)活性剂的混合物。将油相充满整个芯片流道后,再将油水两相样本流体按照一定的比例(根据液滴尺寸需求,气压在2~20 kPa 范围内调节)加压注入到微流控芯片中,生成用于ddPCR 的液滴。
1.2.4 荧光定量PCR 扩增实验
采用鸭源性成分恒温扩增检测试剂盒,反应体系包括37.5 μL 的E 缓冲溶液、2.5 μL 的B 缓冲溶液(Mg2+等)以及0~10 μL 的核酸模板(浓度为100000 copies/μL),不足10 μL 以无菌水补齐。扩增反应参数为扩增温度39~42 ℃,孵化时间4 min,检测通道为FAM,扩增时间15 min。阴性对照组以10 μL 无菌水代替核酸模板。
1.2.5 微流控芯片检测
将包含有扩增后鸭源核酸样本的液滴注入观察芯片,采用荧光显微镜采集荧光图像。采用Image J软件处理采集的荧光图片数据,调整阈值区分液滴的阴阳性,并依据灰度区域的面积区分大小液滴,依据泊松分布原理折算统计计算两个体积液滴分别对应的核酸丰度。
2 结果与讨论
2.1 双体积芯片的制作与液滴的制备
双体积液滴微流控芯片的结构如图1 所示,整体结构为“三明治”结构,自下而上由载玻片基底、PDMS 流道和盖玻片叠加而成。由于芯片的阶梯孔为通孔,为方便后续液滴在下游流道顺利导出,需要在通孔顶部通过键合载玻片将其密封(等离子键合机, 65 W, 30 s)。芯片的油相与水相流道的宽度均为100 μm,高度均为40 μm,在十字交叉区宽度收缩为宽度60 μm,阶梯孔直径为5 mm。
双体积液滴微流控芯片采用标准的软光刻工艺加工,其工作原理如下:通过调节油/水两相流体的进样压力,在十字流道生成不同尺寸的液柱状母液滴,其体积可通过显微图像中液柱的长度和微流道的高度计算;当液柱状母液滴接近阶梯区,下游阶梯结构内流场压力骤降,在压力差与表面张力的综合影响下,母液滴会自发乳化成滴。受到喷嘴处表面张力的约束,液滴的曲率无法无限制增大,因此其尺寸主要取决于喷嘴的几何尺寸。若阶梯结构的上游流体为连续的水相,该过程称之为阶梯乳化。在本研究中,阶梯结构上游的水相体积并非无限供给,因此下游子液滴的体积不再遵循阶梯乳化的物理规律。根据质量守恒原理,阶梯结构下游二次乳化生成的子液滴体积和数量取决于上游母液滴的体积。若液柱母液滴的体积恰好是乳化液滴体积的整数倍(实际上,此处并非需要严格遵守理想整数倍,仅需满足在统计误差允许的范围内近似为整数倍即可),则可在下游获得尺寸均一、单峰正态分布的液滴群;若液柱母液滴的体积不是乳化液滴体积的整数倍,则在阶梯处断裂生成的*后一个子液滴与前序子液滴的体积不再相等,而是取决于液柱状母液滴内水相流体的残余量。此过程仅需要一步操作即可得到双体积的液滴,在下游获得两种尺寸、双峰正态分布的液滴群。通过调节油/水两相流体的进样比例控制液柱状母液滴的体积,即可精准调控下游子液滴的数量和体积。
为验证上述原理,首先以无菌水溶液为分散相研究双体积液滴的两种尺寸关系。将芯片与油相和水相连接后,设置油相压力为4.0 kPa、水相压力为3.8 kPa,得到显微图像序列(图2)。由图2A 可见,在阶梯结构的下游可以观察到两种尺寸的子液滴。图2B~2D 展示了液柱状母液滴临近阶梯时的界面演化过程。母液滴头部首先膨胀,形成舌状前驱体;而后舌状前驱体发生颈缩形成球状前驱体,并从母液滴脱离,形成一个子液滴。此后,上游母液滴中残余的水相体积不足以维持前序子液滴的体积,便在下游处生成了较小体积的*末一个子液滴。
通过改变油相与水相驱动压力的比例,进而调控液柱状母液滴的体积,进一步印证双体积液滴的工作原理。如图3 所示,保持油相压力为4.0 kPa,调节水相压力(3.8~4.0 kPa),液柱状母液滴的长度逐渐增加。由图3 可以明显看到,随着液柱状母液滴长度增加,下游二次乳化的较大子液滴的尺寸几乎不变(仅取决于喷嘴尺寸);由于液柱母液滴内残余水相体积的增加,下游乳化生成的较小液滴的尺寸也逐渐增加,符合预期。采用本方法可以灵活调整下游子液滴的体积和数量。
在油相压力4.0 kPa、水相压力3.8 kPa 的条件下液滴的显微图像和统计直方图如图4 所示,下游子液滴的直径均服从双峰正态分布((40.95±1.61) μm 和(51.48±1.29) μm),两种体积液滴直径的变异系数分别为3.92%和2.51%,满足核酸定量实验需求。图4A 中有极少数的巨型液滴为液滴融合导致,可能是外部振动和微液滴撞融等偶然因素诱导产生的。
2.2 双体积数字PCR 检测DNA
为了探究两种体积液滴所具备的不同的绝对定量能力,设计了3 种不同丰度的鸭源DNA 作为分散相开展核酸检测ddPCR 实验。3 种待测样本的核酸丰度分别为500、5000 和20000 copies/μL,并设置不含核酸的无酶去离子水作为空白对照组。通过双体积微流控芯片制备双体积液滴,将所生成的液滴导出,使用PCR 扩增仪进行扩增后,将液滴导入平铺层观察区,选择FAM 荧光通道观察和分析扩增结果。图5 展示了不同丰度鸭源DNA 模板扩增的荧光结果的灰度图。
从上述结果可见,随着DNA 丰度增加,若以小体积液滴作为定量计算的基准, DNA 靶标的折算偏差从7.722%逐渐减小到0.281%;若以大体积液滴作为定量计算的基准, DNA 靶标的折算偏差从0.444%逐渐增加到17.822%。以偏差不超过5%的可靠性作为阈值,在检测低浓度DNA 靶标时,小体积液滴的绝对定量能力并不理想。同理,随DNA 浓度增加,大体积液滴的定量偏差逐渐增大,在高浓度时其偏差为17.882%,若是继续增加DNA 浓度,大体积液滴将无法实现可靠的绝对定量检测。因此,在面对未知浓度的DNA 靶标时,非常有必要采用不同体积的液滴以满足检测可靠性的要求。
3 结论
为降低对未知丰度核酸样本定量检测的试错成本,本研究设计了一款可生成双体积液滴的微流控芯片,两种体积液滴的数量与体积可通过改变油水两相流体的进样条件灵活调控。上游的十字流道处生成液柱状母液滴,在下游阶梯处二次乳化成两种尺寸的子液滴群,双体积液滴群具有优越的分散性,满足ddPCR 实验需求。以鸭源性DNA 的ddPCR 核酸检测为例考察方法的性能,结果表明,不同体积的液滴包裹同一核酸样本时,折算得到的核酸丰度具有不同的定量精度。后续工作将研究双体积液滴生成和调控机理,尝试采用注塑工艺加工双体积液滴微流控芯片,以满足更多应用场景的需求。


 扫一扫,手机浏览
扫一扫,手机浏览









